2型糖尿病患者的新选择:SGLT2抑制剂
时间:2017-12-21 作者:联创生物医药信息部
肾脏在糖代谢过程中有着非常重要的作用,葡萄糖在肾小球滤过,并在肾近曲小管重吸收。钠葡萄糖转运蛋白(SGLTs)属于SLC5葡萄糖转运蛋白家族,SGLTs在肠(SGLT1)和肾(SGLT1和SGLT2)中均有表达。SGLT2主要分布在肾脏近曲小管S1部位,是一种高容量的低亲和性转运体,其主要生理功能是在肾脏近曲小管完成肾滤液中90%葡萄糖的重吸收;相反,SGLT1是高亲和性低容量的转运体,主要分布在肾脏近曲小管的S2/S3部位,将剩余的10%的葡萄糖重吸收。SGLT2促进葡萄糖逆浓度梯度‑主动运输。随后,细胞内葡萄糖由被动扩散离开细胞,通过葡萄糖转运蛋白2 (GLUT2)进入血液(如图1)。

SGLT2抑制剂的发现
1835年,法国科学家在果树的树皮中分离得到根皮苷(Phlorizin,图2),30年后,有人发现摄入大量根皮苷后会产生尿糖,进一步研究发现,根皮苷会抑制肾小管对葡萄糖的重吸收,并且发现根皮苷对肾脏葡萄糖转运蛋白的亲和力是葡萄糖的1000 – 3000倍,这就是人们研究根皮苷治疗糖尿病的开端。但是根皮苷在体内极易水解成根皮素和葡萄糖,对SGLT1和SGLT2的选择性差,不良反应较大,故而不能广泛应用。但是它带给了人们很好的思路,在根皮苷的基础上,继而开发出更高效稳定的SGLT2抑制剂。

SGLT2抑制剂的发展
目前大多数SGLT2抑制剂仍是在根皮苷基础上发展而来。最初,Tsujihara等人通过研究根皮苷衍生物对增加尿葡萄糖分泌(UGE)的作用,探究其构效关系。根皮苷由A、B、C三个环构成,两个芳香环通过三个碳相连。A环上的4-OH可以被其他基团取代,如一些小的取代基团OMe、H、Me、Et、Cl 、呋喃环、噻吩环等(如下图3所示)。

A环3或4位可以被取代,B环上的4'-OH并非必需基团。与4'-OH相比,B环部分的修饰4'-Me或4'-Et能增加UGE;若将6'-OH改为6'-H或6'-烷氧基,则其活性降低甚至失活;A、B环也可由芳香杂环取代,A,B两环间由1-3个碳相连活性最好,糖环部分OH可以被F、CF3等基团取代;将葡萄糖基团换成半乳糖或木糖等其他糖类取代基,均会改变其活性。B环与C环之间的连接可以为C-O,C-C或C-N连接。氧苷B环上是1',2'邻位取代,碳苷B环上是1',3'间位取代。
经过大量研究,SGLT2抑制剂的O-葡萄糖苷的药效基团如下图4所示,并且要求O-葡萄糖苷SGLT2抑制剂中心区域为环状的平面结构,在中心区域的末端连接着芳香环及其衍生物。

后来,有人总结了O-葡萄糖苷SGLT2抑制剂的构效关系,如下图5,所示:
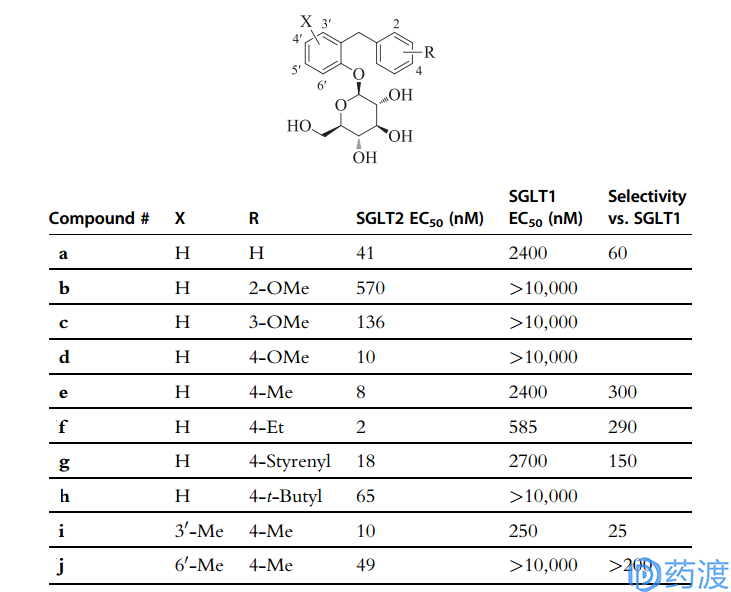
图5. O-葡萄糖苷SGLT2抑制剂的构效关系
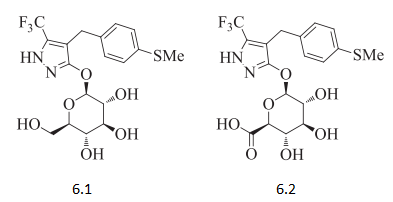
此外,Wyeth发现,带苯环的吡唑啉酮在小鼠(mice)试验中证实有一定的降血糖作用,但在大鼠(rats)身上却没有活性,研究人员进而合成出如下化合物如图6.1,6.2。并证明6.1是潜在的SGLT2抑制剂(22nM SGLT2 EC50)。
鉴于O-苷的化学不稳定等原因,人们又研究了C-苷类SGLT2抑制剂,意外地得到一个稳定并且高效的化合物(如图7)。在此基础上,发现该化合物的极性取代基将降低它的活性。由此,人们进一步开发了一系列化合物,它们的构效关系如图8所示。通过计算化学得出,该类化合物的构象能量较低,所以更稳定。其中,a化合物是潜在的SGLT2抑制剂(EC50=22nM),亲和性是SGLT2的600倍,同时对GLUT1和GLUT4(葡萄糖转运体)无抑制作用。从取代位置方面讲,间位取代可以增加SGLT1的亲和性;邻位取代将会降低化合物活性,c化合物的活性比b低20倍;d的间位取代不能提高化合物的活性,但还可以接受;对位取代基有很强的活性,非极性取代基像Et 、MeO或者MeS可以使化合物活性增加10-20倍。
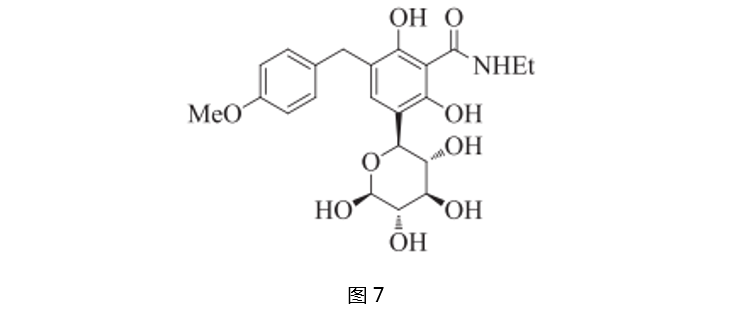
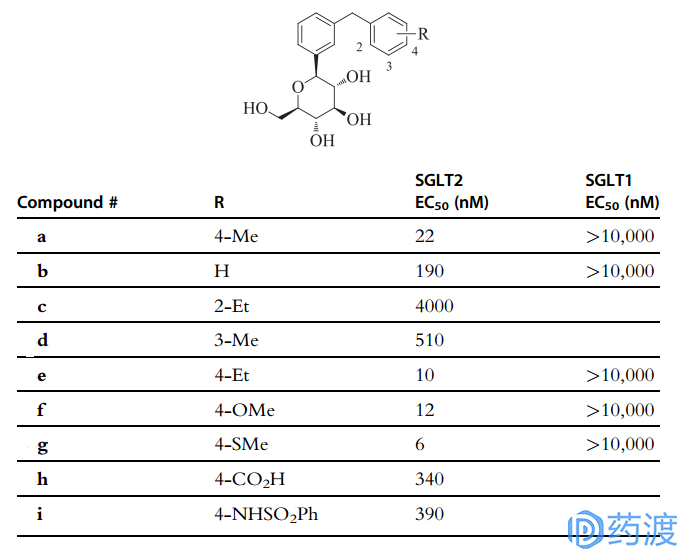
图8. C-苷类SGLT2抑制剂的构效关系
上图所示化合物皆为改变末端区的苯环上连接的基团,接着,人们又在中心区域动起手脚,合成另一类化合物,它们的构效关系如图9所示。可喜的是,在体外实验证明该类化合物都有很好活性,其中C4-和C4’-化合物的EC50值均在1-3之间;口服该类化合物,每小时的血糖水平相当于持续5小时未进食的水平。体外实验也证明,C4位取代基最好为Me、Cl、F、OMe、Et、SMe等结构;C4’位的取代基如果比OMe、Et大,将会影响活性;若C4’位的H被F取代,将会增加SGLT1的亲和性,若换成Cl,则对其亲和性降低1000-2000倍;若C4’位的H被OMe或Et取代,则降低化合物的选择性,增加SGLT1的亲和性。
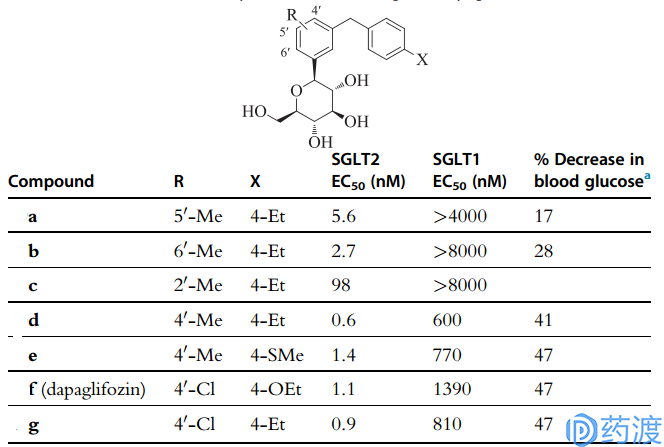
图9.改变中心区域化合物的构效关系
由于e、f、g的表现尤为出色,最终f胜出,由于e和g的易氧化性。f就是我们所说的Dapagliflozin,于2012年11月在欧洲上市,2014年1月被美国FDA批准上市,商品名Farxiga(图10所示)。

目前,已上市的药物除Dapagliflozin仍有以下几种: Canagliflozin、Empagliflozin、Ipragliflozin、Tofogliflozin、Luseogliflozin。
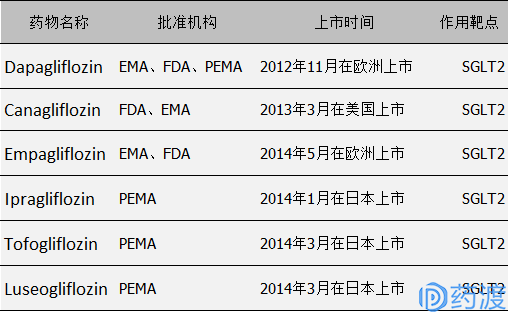
图11.已上市SGLT2抑制剂一览表
同样地,Canagliflozin的发现也是将图4的苯环换成其他芳香环(图12),最终得到图13化合物,并通过临床试验,于2013年3月由美国FDA批准上市。Canagliflozin与双胍类或磺酰脲类联用可以产生较好的效果。总地来说,Canagliflozin有良好的耐受性,通常的不良反应是尿道感染,可以额外使用抗菌药;还会出现渗透性利尿、垂直性低血压、口渴等症状;有极少部分人会出现LDL胆固醇升高现象;关于肾脏的不良反应未见报道。
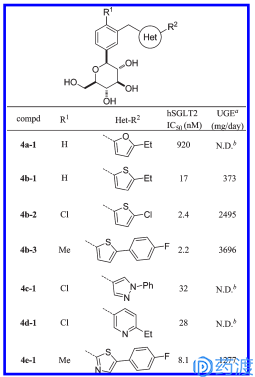
图12. Canagliflozin构效关系
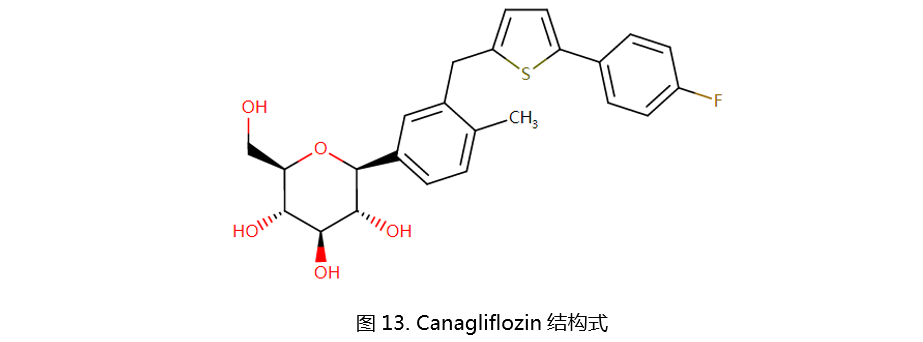
Empagliflozin由勃林格殷格翰和礼来公司研发,作用效果Dapagliflozin类似,它们同样有着良好的耐受性与类似的不良反应,包括无尿或少尿、脱水、酮酸中毒、尿道感染等。Empagliflozin的结构如图14所示。
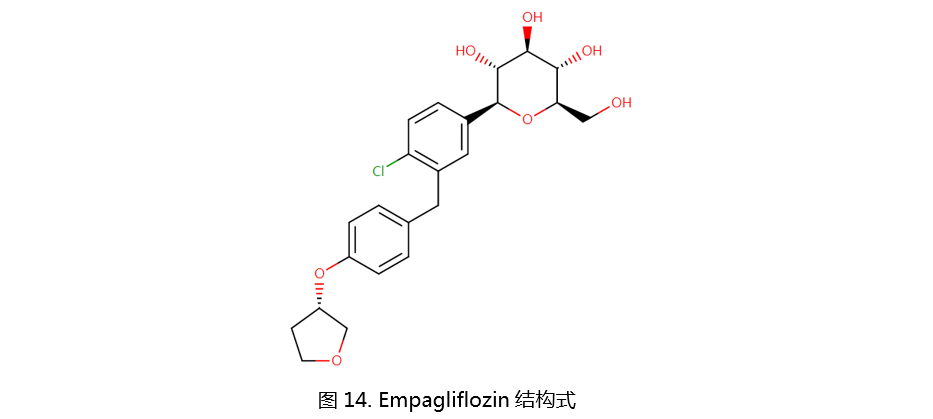
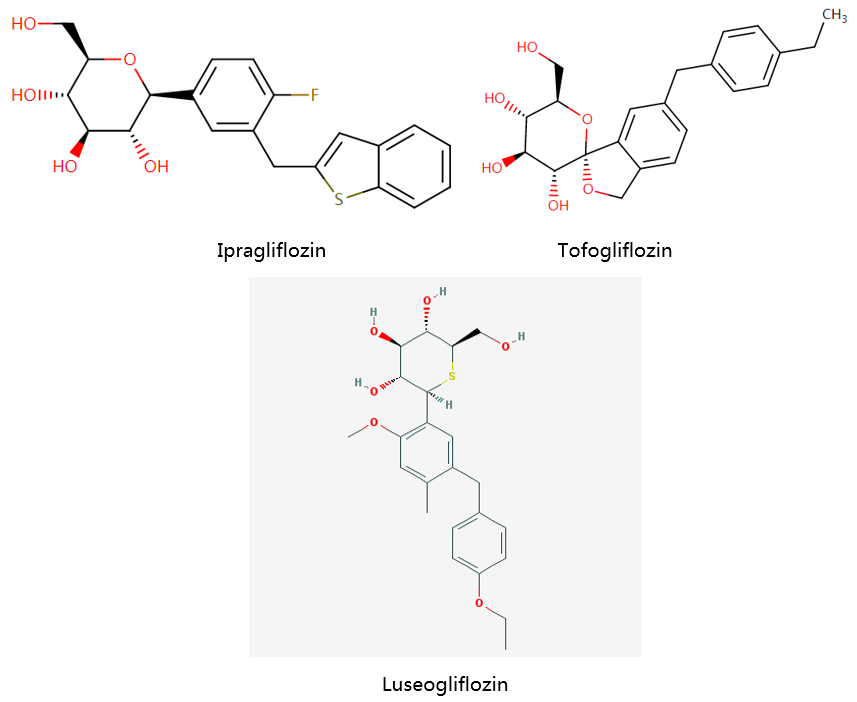
Ipragliflozin、Tofogliflozin和Luseogliflozin均由日本PEMA批准上市。其结构如下:
SGLT2抑制剂的优势与发展趋势
作为新型的降血糖药物,SGLT2抑制剂与其他药物相比有明显的优势:(1)它们可以降低餐前和餐后血糖的水平(并不是所有药物能同时降低两者);(2)由于它们并非刺激胰岛素分泌,所有使用者的低血糖风险比较低;(3)由于其对肾小管的主要作用,产生利尿效果,从而降低了收缩压;(4)有研究发现,SGLT2抑制剂对糖尿病肾病有治疗作用。
目前,越来越多的公司加入到SGLT2抑制剂的研发当中,仍有很多药物进行临床试验,非Phlorizin类SGLT2抑制剂也在发展之中,如ISIS-SGLT2Rx,一种反义抑制性microRNA分子;还有公司发展SGLT1和SGLT2双重抑制剂。
参考文献:
(1)Case History: Forxiga (Dapagliflozin),a Potent Selective SGLT2 Inhibitor for Treatment of Diabetes.
(2)SGLT2 inhibitors: a novel choice for the combination therapy in diabetic kidney disease.
(3)Phlorizin: a review
(4)SGLT2 inhibition — a novel strategy for diabetes treatment.
(5)http://www.drugs.com
(6)Discovery of a Potent,Selective Renal Sodium-Dependent Glucose Cotransporter 2 (SGLT2) Inhibitor (HSK0935) for the Treatment of Type 2 Diabetes.
(7)Discovery of Canagliflozin,a Novel C-Glucoside with Thiophene Ring,as Sodium-Dependent Glucose Cotransporter 2 Inhibitor for the Treatment of Type 2Diabetes Mellitus1.
(8)Canaglifl ozin: A Novel SGLT2 Inhibitor for Type 2 Diabetes Mellitus.